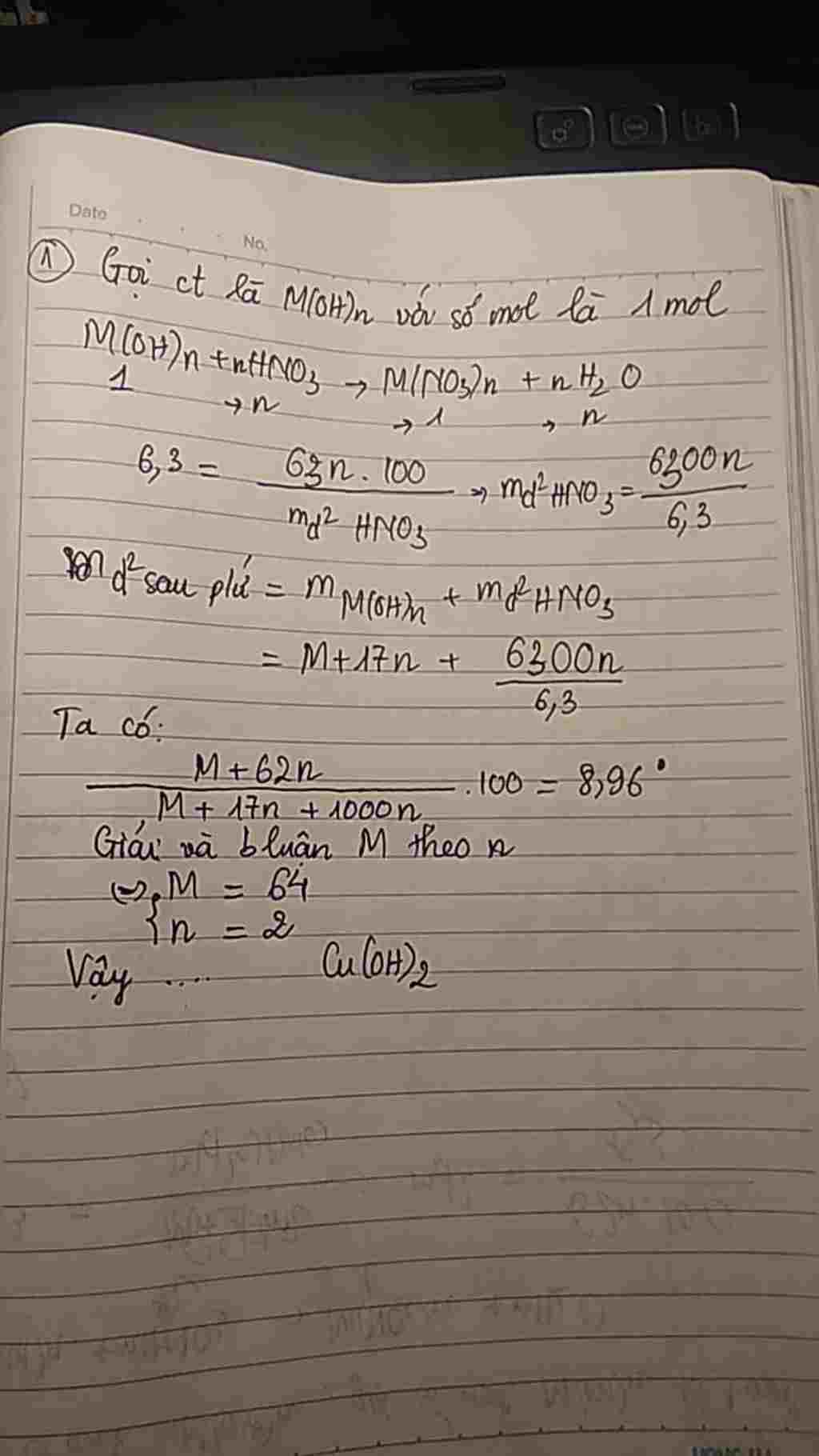Câu hỏi:
Giúp em bài tập về nhà Hóa học lớp 9 câu hỏi như sau: 1 Hòa tan hiđroxit kim loại M bằng một lượng vừa đủ dung dịch HNO3 nồng độ là 6.3% người ta thu được 1 dung dịch muối nitrat có nồng độ 8.96%. Xác định công thức hiđroxit đã dùng
2 Một hỗn hợp kim loại gồm 90% khối lượng là nhôm và 10% khối lượng là Mg tan hết vào dung dịch HCl 2M thấy thoát ra 0.65 g khí
a Tính khối lượng hỗn hợp
b Tính thể tích HCl đủ cho phản ứng
c Tính nồng độ mol của các chất thu được khi lượng axit vừa đủ ( V thay đổi không đáng kể)
Trả lời 2:
Gia Sư Hoàng Khang gữi câu trả lời dành cho bạn:
1.Giả sử có 1 mol M(OH)n tác dụng vừa đủ n mol HNO3 -> mdung dịch HNO3=1000n gam.
Sau phản ứng thu được dung dịch có khối lượng
-> mdung dịch=1017n+1M gam
Muối thu được là M(NO3)n 1 mol -> (M+62n)/(1017n+M)=8,96%
Thay n=1 thì M=32 (loại)
n=2 thì M=64 thỏa mãn M là Cu -> hidroxit là Cu(OH)2.
n=3 loại
2.
Gọi số mol Al và Mg lần lượt là x, y
-> 27x/(27x+24y)=90%
Ta có nH2=0,325 mol -> 1,5x+y=0,325
GIải được x=0,2; y=0,025 -> mhh=8,1 gam
Ta có nHCl=2nH2 =0,65 mol ->V dung dịch HCL=0,325 lít
Dung dịch sau phản ứng thu được chứa 0,2 mol AlCl3 và 0,025 mol MgCl2
->CM AlCl3=0,2/0,325; CM MgCl2=0,025/0,325
Trả lời 1:
Gia Sư Hoàng Khang gữi câu trả lời dành cho bạn:
Đáp án:
Bạn xem lời giải ở dưới nhé
Giải thích các bước giải: