Câu hỏi:
Giúp em bài tập về nhà Hóa học lớp 10 câu hỏi như sau: nguyên tử Au có bán kính và khối lượng mol là 1,44 A* và 197 g /mol . Biết rằng khối lượng riêng của Au chiếm 19,36 g/cm^3 . Hỏi các nguyên tử Au chiếm bao nhiêu phần trăm trong tinh thể
Trả lời 2:
Gia Sư Hoàng Khang gữi câu trả lời dành cho bạn:
Đáp án:
Giải thích các bước giải:
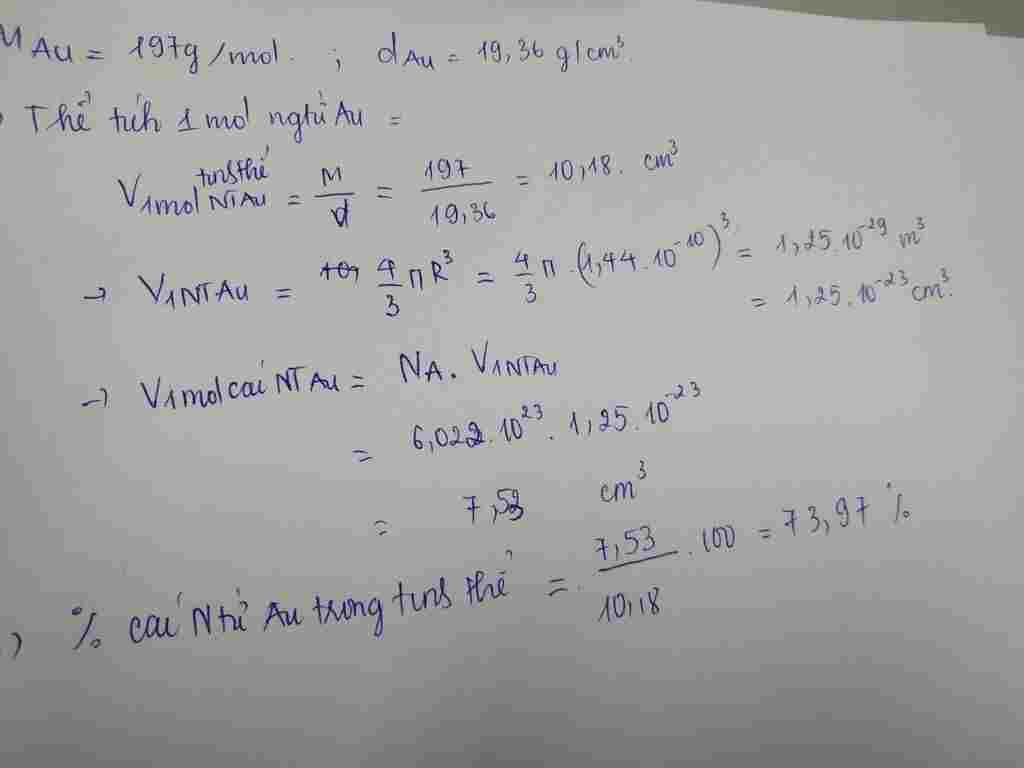
Trả lời 1:
Gia Sư Hoàng Khang gữi câu trả lời dành cho bạn:
Giải đáp:
$73,98\%$
Lời giải và giải thích chi tiết:
Đổi: $\rm 1,44\mathop{A}\limits^{o}=1,44.10^{-8}cm$
Khối lượng của 1 nguyên tử Au:
$\rm m_{1\ nguyen\ tu\ Au}=\dfrac{197}{6,022.10^{23}}≈3,27134^×10^{-22}\ (gam)$
Thể tích của 1 nguyên tử Au:
$\rm V_{1\ nguyen\ tu\ Au}=\dfrac{4}{3}\pi.R^3=\dfrac{4}{3}\pi.(1,44.10^{-8})^3≈1,25^{-23}\ (cm^3)$
Khối lượng riêng của 1 nguyên tử Au:
$\rm d_{1\ nguyen\ tu\ Au}=\dfrac{m}{V}=\dfrac{3,27134×10^{-22}}{1,25.10^{-23}}=26,17\ (g/cm^{3})$
Thể tích chiếm bởi các nguyên tử Au:
$\dfrac{19,36}{26,17}×100\%=73,98\%$





